
Новиков Д.К.,Новиков П.Д., Новикова В.И.
Иммунодефицитные инфекционные болезни
Витебский государственный медицинский университет ордена Дружбы народов
Novikov D.K., Novikov P.D., Novikova V.I.
Immunodeficient infectious diseases
Представление о том, что инфекция – процесс, полностью зависимый от микроорганизма, доминирует в сознании врачей. Те же важнейшие нарушения в системе иммунитета организма, которые предшествуют ей, т.е. иммунодефициты, – игнорируются. Отсюда и главная лечебная доктрина – любыми способами уничтожить микроорганизм, что вызывает появление все более резистентных его вариантов, а попытки «стерилизации» макроорганизма индуцируют дисбиозы и хронические формы иммунопатологии.
Зависимость инфекций от иммунитета
После того как в 1941 г. Я. Флемингом был открыт пенициллин и показана его эффективность при инфекциях, ассоциированных с бактериями, в медицине окончательно утвердилась концепция, согласно которой основным средством лечения инфекций являются противомикробные препараты.
Несмотря на определенные успехи их применения, в последние десятилетия накапливается все больше данных об их неэффективности и угрожающе нарастающей резистентности к ним микробов. В связи с этим необходима новая стратегия борьбы с инфекциями.
Инфекционные болезни – это обширная группа заболеваний человека, вызываемых патогенными вирусами, бактериями, риккетсиями, грибами и простейшими у чувствительных макроорганизмов [5]. Они – ведущая причина смертности в мире: ежегодно погибает около 17 миллионов человек. Появились новые инфекции – ВИЧ-инфекция, лихорадка Эбола, атипичная пневмония и др. Отмечается активация известных ранее болезней – туберкулеза, гепатитов, малярии в связи с изменчивостью микроорганизмов и модуляцией иммунореактивности людей в сторону повышения их чувствительности.
Взаимодействие между системой иммунитета и микроорганизмом может либо не иметь последствий, либо привести к колонизации им тканей, что проявится широким спектром клинических вариантов инфекционного процесса [5].
Инфекция (инфекционный процесс) – патологический процесс в организме, возникающий вследствие взаимодействия между патогенным микроорганизмом и клетками и тканями неиммунного, чувствительного макроорганизма, сопровождающийся размножением микроорганизма, изменением реактивности макроорганизма, повреждением тканей [13]. Инфекция – это один из возможных результатов взаимодействия микро- и макроорганизма. Другой, вероятно, более частый, – естественная резистентность, возникновение иммунитета или его усиление (при наличии).
Хотя индукция и интенсивность инфекционного процесса зависят от дозы, вирулентности, пути проникновения возбудителя, однако главным является степень недостаточности естественного или приобретенного иммунитета макроорганизма. Именно недостаточность иммунитета – относительный (к данному возбудителю) или абсолютный иммунодефицит – в каждой конкретной ситуации служит определяющим фактором развития инфекции (рис. 1).
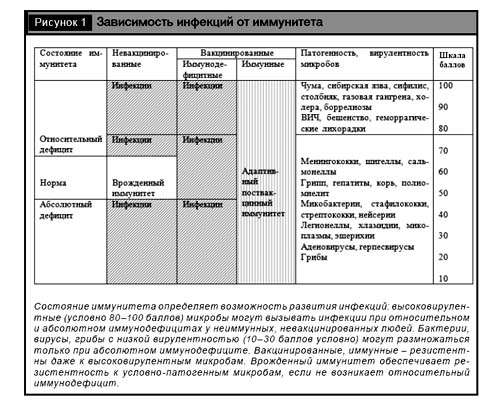
Главное условие возникновения инфекционного процесса – восприимчивость макроорганизма, т.е. недостаточность его иммунитета (иммунодефицит), когда даже условно-патогенный микроорганизм может вызвать инфекцию. Высоковирулентный возбудитель, проникший во внутренние среды организма, может преодолеть резистентность нормального, но не иммунного к нему макроорганизма [11, 13].
Инфекционная болезнь, таким образом, – это прежде всего иммунодефицитная болезнь у индивида, когда патогенность проникшего инфекта больше его «иммунитетных возможностей» в момент заражения.
Способность организма человека противостоять различным микроорганизмам обусловлена двумя механизмами: неспецифической противоинфекционной резистентностью, которая сразу направлена на множество инфекционных агентов, и развитием специфического приобретенного иммунитета к конкретным микроорганизмам.
Связь инфекций, «вызываемых» условно-патогенными микроорганизмами, с иммунодефицитом очевидна, так как только при его наличии возможна их экспансия. Именно недостаточность противовирусного или антибактериального иммунитета позволяет размножаться микроорганизмам – аутологичным или поступившим извне.
Облигатно-патогенные бактерии особо опасных инфекций (чумы, сибирской язвы и др.) обладают высокой вирулентностью, факторами подавления и преодоления естественных барьеров иммунитета нормального, но неиммунного к ним организма (относительный иммунодефицит). Для защиты от них требуется предварительная активация системы иммунитета (СИ), индукция антител и/или иммунных Т-клеток, т.е. создание иммунитета, тогда и эти бактерии не могут его преодолеть.
Результатом взаимодействия микробов и макроорганизма может быть нестерильный иммунитет, когда факторы патогенности и иммунитет уравновешены; стерильный иммунитет – освобождение от инфекта; инфекция – размножение вирулентного микроба. Только при поступлении в здоровый организм большой дозы высоковирулентных микроорганизмов могут преодолеваться его защитные барьеры и иммунитет, когда соотношение инфицирующей дозы на единицу защитного фактора, например на один фагоцит, будет превышать какой-то критический уровень и фагоцит не в состоянии поглотить и переварить данное число микробов. В такой ситуации ([доза + вирулентность] > [барьеры + иммунитет]) наблюдается относительный иммунодефицит, что характерно для особо опасных бактериальных инфекций (чумы, сибирской язвы, холеры), некоторых вирусных инфекций (бешенство, геморрагические лихорадки и др.). Однако даже при развитии эпидемий чумы в древности, часть людей оставались здоровыми за счет повышенной естественной резистентности и иммунитета. После эффективной вакцинации высоковирулентные микроорганизмы уже не могут преодолеть приобретенный (адаптивный) иммунитет (см. рис. 1).
Условно-патогенные микробы вызывают инфекции у людей с дефектами в системе иммунитета, когда для этого достаточно небольшой дозы микроорганизмов, не инфицирующей людей с нормальной системой иммунитета, т.е. при наличии абсолютного иммунодефицита.
Иммунодефицит (ИД) – относительный или абсолютный – главная причина инфекций, так как при повышении, стимуляции иммунитета после вакцинации возникает резистентность ко многим высоковирулентным возбудителям. Так, путем вакцинации населения была ликвидирована оспа, уносившая миллионы людей, индуцируется невосприимчивость к кори, полиомиелиту, гриппу, гепатиту В, клещевым энцефалитам, желтой лихорадке и другим инфекциям [17]. Это доказывает, что даже высоковирулентные возбудители не могут преодолеть предварительно мобилизованные иммунитетные барьеры организма. Следовательно, вирулентность возбудителей инфекций не абсолютна, и организм с достаточно высокой степенью специфической и неспецифической активности СИ, т.е. иммунный, в состоянии противостоять ей. Отсюда следует, что резистентность, иммунитет организма, а не вирулентность возбудителя служит определяющим фактором развития любой инфекции. Поэтому инфекционные болезни следует рассматривать как «иммунодефицитные инфекционные болезни» или «иммунодефицитные болезни с клиникой инфекций». Основой стратегии их профилактики и лечения должно быть повышение невосприимчивости, активация иммунитета восприимчивого организма.
При относительном ИД в здоровом неиммунном организме на инфект развивается острая воспалительная реакция и иммунный ответ, который при лечении и выздоровлении нейтрализует его, после чего обычно возникает адаптивный иммунитет. Если этого не происходит, относительный ИД может стать абсолютным, что приводит к тяжелому исходу. Попытки оценивать острую инфекционно-воспалительную реакцию как нормальный ответ и как бы «физиологическое состояние» [7] – то же самое, что считать больного здоровым, а смерть от такого острого воспаления – естественной смертью. Нормальная, физиологическая, работа СИ обеспечивает нейтрализацию инфектов, патогенов без клинических синдромов воспаления и развития генерализованной иммунной реакции, на уровне местных, врожденных или приобретенных факторов иммунитета, как это и происходит в иммунном организме после вакцинации или перенесенной ранее инфекции.
С этих позиций антимикробная терапия (противовирусная, противобактериальная) имеет значение, с одной стороны, как способ уменьшения инфицирующей дозы возбудителя, приближающий ее к относительно недостаточному иммунитетному барьеру, а с другой, – как средство получения антигенов и липополисахаридов разрушенных микробов, стимулирующих иммунитет и повышающих этот барьер.
Поэтому даже при персистенции многих условно-патогенных вирусов и бактерий в организме не всегда наблюдается инфекция, если нет ИД.
Следовательно, без иммунодефицита нет инфекции, а она есть клиническое проявление иммунодефицитной болезни (ИДБ).
Комплекс клеточных структур и факторов естественного врожденного иммунитета (рис. 2) может полностью элиминировать микроорганизмы без развития специфического иммунного ответа. В этот комплекс входят гуморальные факторы: лизоцим, С-реактивный белок (СРБ), маннансвязывающий белок (МСБ), комплемент (альтернативный путь активации), трансферрин, а также лейкоциты (нейтрофилы, макрофаги), которые выделяют ранние цитокины – ФНОальфа, ИЛ-1, ИНФгамма и др., активирующие все клетки СИ.

Естественные антитела В1-лимфоцитовсерозных полостей – важный фактор врожденного иммунитета. Антитела классов IgM и sIgA, образуемые ими, осуществляют врожденный антибактериальный иммунитет, в первую очередь, против бактерий кишечника, а также капсулообразующих микробов (пневмококков, гемофильной палочки). IgM-антитела оказывают комплементзависимую цитотоксичность, а sIgA опсонируют до 90% бактерий тонкого кишечника, препятствуя их адгезии к эпителию. Эти антитела исходно специфичны к распространенным антигенам бактерий: фосфорилхолину, полисахаридам и липополисахаридам (ЛПС).
Представляющие врожденный клеточный иммунитет гамма дельта -Т-клетки во многом определяют резистентность мышей к M.tuberculosis, дефицитные по ним мыши быстро погибают от этой инфекции [24].
Специфический приобретенный иммунный ответ развивается в макроорганизме против антигенов возбудителя, его токсинов и других продуктов жизнедеятельности или против антигенов вакцин и анатоксинов. В результате такого взаимодействия клетки СИ, в первую очередь макрофаги, дендритные клетки, распознают чужеродные антигены уже в местах их первичного внедрения и запускают иммунный ответ.
В зависимости от химической природы антигенов возбудителя, внутри- или внеклеточной его локализации и других факторов иммунный ответ макроорганизма может происходить с преобладанием Т-клеточного или антительного В-клеточного иммунитета с образованием вначале IgM, а затем IgG и IgA антител. После элиминации возбудителя клоны эффекторных клеток под влиянием супрессии иммунного ответа уменьшаются и остаются долгоживущие клетки памяти, обеспечивающие длительный, а при некоторых инфекциях – пожизненный иммунитет.
Приобретенный иммунитет к бактериальным инфекциям различается по механизмам в зависимости от факторов патогенности возбудителя. В одних случаях, когда бактерии выделяют токсины или чувствительны к антителам, он эффективен: в других – неэффективен, например при индукции антител к внутриклеточным бактериям; в третьих, при выделении избытка цитокинов, иммунный ответ повреждает собственные ткани.
Бактериальные инфекции, которые зависят от продукции экзотоксинов, индуцируют антитоксический иммунитет (дифтерия, столбняк, ботулизм и др.). Ведущая роль в нейтрализации токсинов принадлежит IgM и IgG-антителам. IgM-антитела в крови выявляются уже через 48 часов после заражения и достигают пика через 7–10 дней (при инфекциях – позже) [9]. Затем преобладают IgG-антитела.
Основным механизмом антибактериальной защиты является фагоцитоз [16, 21]. В иммунном организме эффективность фагоцитоза повышается за счет опсонизирующего действия специфических IgM и IgG-антител, взаимодействующих Fab-фрагментами с антигенами на поверхности бактерий и одновременно с Fc-рецепторами на мембранах фагоцитов. Это приводит к окислительному взрыву и активации других бактерицидных систем фагоцитирующих клеток [18].
Активация системы комплемента комплексами «антитела–бактерии» приводит к разрушению липопротеиновых оболочек грамотрицательных бактерий, особенно нейссерий, а также к высвобождению анафилотоксинов, которые стимулируют дополнительный приток из плазмы крови гуморальных компонентов иммунитета и вызывают хемотаксис полиморфноядерных лейкоцитов, осуществляющих фагоцитоз.
Во всех секретах IgA, связавшись с бактериями, предотвращает их адгезию к поверхности слизистой. Секреторная система иммунитета защищает контактирующие с внешней средой слизистые оболочки. IgE, связанные с тучными клетками слизистых оболочек, могут стимулировать аллергическое воспаление с участием лейкоцитов.
Внутриклеточно паразитирующие бактерии: микобактерии туберкулеза, бруцеллы, сальмонеллы и др., а также риккетсии, хламидии и микоплазмы отличаются повышенной устойчивостью к гибели после фагоцитоза. Они защищаются от механизмов уничтожения, подавляя слияние фагосом с лизосомами, образуя наружную оболочку или выходя из фагосом в цитоплазму. Эти бактерии уничтожаются механизмами Т-клеточного иммунитета и активированными макрофагами [10, 24]. Специфические цитокин-продуцирующие Т-хелперы при контакте с зараженными макрофагами выделяют гамма-интерферон, активирующий естественные киллеры (ЕК) и макрофаги, которые становятся после этого более эффективными, что наблюдается и при противовирусном иммунитете [21, 24]. Однако важнейший механизм – это индукция активности Т-киллеров, которые разрушают инфицированные клетки и делают доступными бактерии для других бактерицидных факторов, в том числе для активированных макрофагов.
Продукты разрушения бактерий, в частности ЛПС, индуцируют запуск цитокинов (ИЛ-1, ФНОальфа и др.), которые участвуют в развитии эндотоксинового шока и «безмикробного» сепсиса.
Инфекционный процесс сопровождается аллергическими реакциями немедленного и замедленного типа [6, 8]. Изменение реактивности в виде аллергии или парааллергии (неспецифической повышенной реактивности) может предшествовать инфекции и видоизменять течение последней в начальной фазе ее развития. В других случаях организм сенсибилизируется в ходе самой инфекции, что приводит к возникновению последовательно развивающихся аллергических фаз заболевания.
Таким образом, аллергические реакции различного типа при инфекциях отражают иммунологические процессы, не всегда связаны с резистентностью и нередко отягощают течение инфекции [8].
Резистентность к вирусам в иммунном организме, например после вакцинации вирусными вакцинами, при прочих равных условиях с неиммунным организмом по неспецифической резистентности, зависит от наличия специфических факторов иммунитета – IgG, IgM, секреторных IgA-антител, возможно, IgD-антител, а также иммунных Т-киллеров [12, 13, 24].
Исход борьбы «вирус – организм» зависит от скорости и динамики синтеза антител и развития иммунного ответа в целом. При острой сублетальной инфекции у мышей, вызванной вирусом гриппа, Т-хелперы активируются через 24–36 ч, Т-киллеры – 2–3 дня, IgM появляются на 5–6-й день, IgG и IgA – на 8–9-й; пик концентрации вируса в зависимости от дозы инокулята достигает пика уже к 3–6-му дню [13, 24].
Комплемент нейтрализует некоторые вирусы, покрытые антителами. Без антител он способен инактивировать вирусы, имеющие рецепторы для С1q комплемента (ретровирусы и др.), связывая который, они активируют классический путь его активации.
Важным фактором противовирусного иммунитета служат вирусспецифические Т-киллеры. Вирус-специфические Т-клетки находят как при иммунитете, так и при персистирующей инфекции, однако для иммунитета количество их должно быть достаточным. Так, в крови больных, выздоравливающих от инфекционного мононуклеоза имелось 2250–8200 CD8+-Т-клеток (35% HLA-DR+CD8+ и 34–60% CD45RO+CD8+) в 1 мкл специфичных против вируса Эпштейн–Барр, что было достаточным для развития иммунитета [13, 24].
При персистирующих инфекциях в крови имеется от 1 до 10% распознающих антиген CD8+ Т-лимфоцитов [12, 24].
Вирусы могут изменять и угнетать иммунный ответ [12, 21]. Механизм нарушения иммунореактивности при вирусных инфекциях может быть обусловлен:
- размножением вируса и разрушением части клеток (лимфотропные вирусы: Эпштейн–Барр трансформируют В-лимфоциты, а ВИЧ разрушает CD4 Т-лимфоциты; вирусы краснухи, ветряной оспы, герпеса, полиомиелита подавляют пролиферацию Т-лимфоцитов);
- активацией макрофагов с выделением ими цитокинов, изменяющих реактивность (ВИЧ-вирус и др.), подавлением экспрессии HLA-DR антигенов на антиген-представляющих клетках, нарушением адгезии, кооперации клеток в иммунном ответе (ВИЧ, вирусы гепатитов, гриппа и др.);
- апоптозом, индуцированным вирусом, некоторых субпопуляций клеток, особенно Т-хелперов; стимуляцией дисбаланса между Тх1 и Тх2, приводящего к развитию иммунодефицита или аллергии (вирус гриппа, аденовирусы, вирус кори и др.);
- цитокиноподобным действием вирусных пептидов, связыванием цитокинов вирусными белками, подавлением их синтеза (цитомегаловирус, вирусы гепатита и др.);
- подавлением бактерицидности нейтрофилов (вирусы кори, гриппа);
- поликлональной активацией Т- и В-лимфоцитов вирусными суперантигенами, угнетающей противовирусный ответ и вызывающей аутоиммунные реакции.
Поэтому вирусы индуцируют иммунопатологические процессы. Комплексы «вирусный антиген – антитело» повреждают сосуды, вызывая васкулиты, которые наблюдаются при многих вирусных инфекциях. В сезон гриппа увеличивается количество инфарктов, а вакцинация против него уменьшает частоту сердечно-сосудистой патологии [13].
Иммунодефицитные болезни с клиникой инфекций
Иммунодефицитная болезнь – врожденная, генетическая или приобретенная структурная и/или функциональная недостаточность какого-то звена в системе иммунитета, клинически проявляющаяся рецидивами инфекции, вызванной вирусами, бактериями, грибами, паразитами [13].
Абсолютный иммунодефицит – генетический и/или лабораторный признак дефекта (недостаточности) звена иммунитета, с клиническими проявлениями или без них; относительный иммунодефицит – недостаточность иммунитета нормального, но неиммунного организма к высоковирулентным возбудителям.
Общие признаки иммунодефицитной болезни
1. Наличие острого или рецидивирующего (хронического) инфекционного процесса любой локализации.
2.Выявление вирусов, условно-патогенных бактерий и/или грибов в очаге поражения.
3. Клинические признаки – стигмы, характерные для первичных иммунодефицитов у детей.
4. Наличие причин (иммуносупрессивных факторов), вызвавших приобретенную ИДБ.
5. Лабораторные признаки иммунодефицита, подтвержденные в динамике.
6. Эффективность иммунокорригирующей терапии.
Два последних (5, 6) признака являются дополнительными, вспомогательными, – для диагноза достаточно двух первых признаков в сочетании с 3-м и 4-м или даже без такого сочетания.
Основная концепция
Причиной любых инфекций, вызываемых условно-патогенными бактериями и грибами, служит абсолютный иммунодефицит – недостаточность конкретных звеньев системы иммунитета.
Вирусы и большие дозы особо опасных, высоковирулентных бактерий могут преодолевать естественные иммунитетные барьеры нормального, но не иммунного организма, создавая относительныйиммунодефицит.
Следствия
1. Нет инфекции без иммунодефицита.
2. Необходимо не только диагностировать инфекцию и выявлять возбудителя, но и определять вид иммунодефицита.
3. Наличие инфекции требует не только антимикробной терапии, но и иммунокоррекции дефицита иммунитета.
Основным клиническим признаком ИДБ является наличие инфекционного синдрома в виде конкретных клинических форм – с рецидивами и обострениями инфекций, вызываемых патогенными или условно-патогенными микроорганизмами: вирусами, бактериями, грибами, паразитами. Инфекционные синдромы могут сочетаться с синдромами гиперактивации СИ – аллергическими и аутоиммунными. Сыпь при инфекциях – тоже проявление аллергии.
Различают первичные и вторичные иммунодефициты (ИД) и соответственно иммунодефицитные болезни, которые, как и инфекции, имеют острое, подострое и хроническое течение.
Первичные ИД – это генетические аномалии, обычно клинически манифестируются у детей, но иногда (например, дефицит cIgA) – только у взрослых. Вторичные ИД возникают у клинически здоровых людей под влиянием различных причин, правда, у многих из них можно выявить генетическую предрасположенность к развитию ИДБ.
Причины вторичных иммунодефицитов:
1. Экологические неблагоприятные воздействия на организм и систему иммунитета (физические, химические, биологические).
2. Заболевания, поражающие систему иммунитета:
– вирусные (чаще);
– бактериальные инфекции, паразитарные инвазии;
– аллергические и аутоаллергические, онкологические;
– нарушения обмена веществ, пролиферации клеток и потеря белка;
– прочие тяжелые заболевания.
3. Иммунодепрессивные методы лечения:
– лекарственная иммуносупрессия;
– лучевая и другие виды энергии в больших дозах;
– хирургические вмешательства и наркоз;
– реакция «трансплантат против хозяина» (РТПХ) после аллотрансплантации костного мозга.
4. Физический и эмоциональный стресс.
5. Недостаточное питание и истощение (белковая, жироуглеводная, витаминная, микроэлементная недостаточность).
6. Профессиональные вредные факторы (химические, физические, психоэмоциональные).
7. Возрастные: недоношенность детей и патология старения («синдром пожилых»).
Среди как первичных, так и вторичных иммунодефицитов можно выделить структурные и функциональные.
Структурные ИД:
- органные – при отсутствии или недостаточности органа иммунитета (аплазия тимуса, аспления, вторичные постспленэктомический и посттонзиллоэктомические синдромы);
- клеточные – при отсутствии или неполноценности клеток системы иммунитета, вследствие недодифференцировки какой-то популяции;
- макромолекулярные – при отсутствии или неполноценности макромолекул (рецепторов, цитокинов), из-за дефектов генов или подавления экспрессии;
- субмолекулярные – при изменении строения отдельных пептидных цепей рецепторов и цитокинов из-за генных мутаций;
- точечные генные, приводящие к изменению последовательности или замене отдельных аминокислот в пептидах (замена триптофана на аргинин в гамма-цепи ИЛ2Rгамма и рецепторах других цитокинов).
Функциональные ИД:
- «функционально-генетические», возникшие в связи с изменением активности генов цитокинов или их и других клеточных рецепторов (первичные ИД – наличие аллельных вариантов генов, мутации интронных областей, вторичные – изменение активности генов под влиянием вирусов и других агентов);
- функционально-клеточные, появляющиеся из-за нарушений функциональных взаимодействий клеток СИ;
- функционально-органные и межсистемные, развивающиеся из-за нарушений регуляции и взаимодействий между различными органами СИ, а также нервной и эндокринной системами.
Эти уровни дефектов СИ во многом определяют методы и тактику диагностики ИДБ. При структурных генных дефектах точная локализация дефекта определяется не только отсутствием конечного продукта (например, IgG2), но структурным генетическим анализом клеток-продуцентов.
При органопатологии СИ (аплазии органа) достаточно клинического обследования. Функциональные дефекты на уровне активности генов могут выявляться по конечным их продуктам (например, цитокинам), а органные – по изменению количества органоспецифических продуктов (например, ферментов, медиаторов).
Инфекционные заболевания и синдромы различной локализации – главные клинические «маркеры» иммунодефицитов, служат клиническими проявлениями («масками») иммунодефицитной болезни. Они представлены двумя большими группами.
I. ИДБ с клиникой инфекционных заболеваний, вызываемые вирулентными возбудителями, возникают на фоне относительного иммунодефицита
II. Клинические «маски» ИДБ, ассоциированные с условно-патогенными микробами, причиной которых обычно является абсолютный иммунодефицит:
– острые и хронические заболевания верхних дыхательных путей и легких;
– очаги инфекции различной локализации (пиодермии, отиты и др.);
– рецидивирующие гнойно-воспалительные заболевания;
– рецидивирующий герпес кожи и слизистых оболочек;
– хронические гастроэнтеропатии и диареи неясного генеза;
– длительный субфебрилитет и лихорадка неясного генеза; синдром мальабсорбции;
– рецидивирующие грибковые поражения слизистых оболочек рта, кишечника, легких;
– лимфоаденопатии, тонзиллиты; гипоплазия лимфоузлов;
– тимомегалия; гиперплазия или гипоплазия вилочковой железы;
– атопический дерматит с пиодермией, крапивница и отек Квинке, аллергические заболевания, осложненные инфекцией;
– гепатомегалия, спленомегалия;
– неадекватные реакции на традиционные методы лечения и профилактику рецидивов заболевания и вакцины (БЦЖ и др.);
– признаки повышенной утомляемости, усталости, слабости, нарушение сна;
– аутоаллергические заболевания, осложненные инфекцией;
– лимфо- и миелопролиферативные заболевания, злокачественные опухоли.
Эти клинические формы можно объединить в следующие группы ИДБ:
1. Первично связанные с повреждением барьеров кожи и слизистых оболочек (фурункулезы, дерматиты, бронхолегочные, желудочно-кишечные, урогенитальные инфекции).
2. Первично обусловленные поражением клеток системы иммунитета (вирусами, иммунодепрессантами, профессиональными факторами и др.).
3. Комбинированные.
Локализацию ИД в некоторых случаях можно определить клинически (табл. 1, 2).
Таблица 1. Клинические признаки различных иммунодефицитов
Признаки
Т-клеточных ИД
В-клеточных ИД
фагоцитарных ИД
Вирусные инфекции
Кожно-слизистый кандидоз (персистирующий более 6 месяцев)
РТПХ с алопецией, эритродермией (после трансплантации костного мозга или переливания крови)
Стигмы – признаки первичных Т-клеточных дефицитов
Лимфопения с дефицитом малых лимфоцитов
СПИД-подобные синдромы
Рецидивирующие пиогенные инфекции
Персистирующая гиперплазия лимфатических узлов кишечника
Повторные эпизоды гнойно-септических заболеваний
Рецидивирующие абсцессы (дефект киллинга)
Локальные бактериальные инфекции (нарушение хемотаксиса)
Таблица 2. Дефекты, на которые указывает инфицирование некоторыми условно-патогенными микроорганизмами
Микроорганизмы
Дефектная система
Haemophilus influence
Str.pneumonia
Staph.aureus
IgA+IgG2 (отиты, хронические бронхиты) Уничтожение бактерий фагоцитами Антитела, С3-компонент комплемента
Neisseria
С6–С9-компоненты комплемента
Salmonella (носительство)
sIgA
БЦЖ (диссеминация)
Клеточный иммунитет
Candida
Клеточный иммунитет
Клинико-лабораторные признаки ИДБ:
• снижение числа лейкоцитов всех типов (лимфоцитов, гранулоцитов, моноцитов), иногда лейкоцитоз некоторых из них (эозинофилия, моноцитоз и др.);
• снижение общего уровня комплемента (С50), гипогаммаглобулинемия при электрофорезе сыворотки крови;
• уменьшение или отсутствие тени вилочковой железы при рентгенографии у детей.
• наличие конкретных микроорганизмов в экссудатах, крови.
Возникшая ИДБ с клиникой инфекции сопровождается дальнейшим угнетением иммунитета. Примером могут служить ИДБ с клиникой хирургической инфекции:
– для гнойной инфекции характерны признаки общей вариабельной иммунодефицитной болезни, при которой отмечаются различные, обычно комбинированные дефекты СИ: фагоцитоза, гуморального и клеточного звеньев иммунитета, цитокиновой сети;
– сепсис – сильнейшая провоспалительная активация клеток СИ (макрофагов, нейтрофилов, Тх): запускается цитокиновый каскад, увеличивается уровень провоспалительных цитокинов (ИЛ-1, ФНОальфа, ИЛ-6 и др.) на фоне снижения ИЛ-10, активируется комплемент, что обусловливает повреждение эндотелия сосудов, клеток нервной и эндокринной систем и приводит к полиорганной недостаточности и тяжелой иммунодепрессии – параличу;
– при остром разлитом гнойном перитоните, абсцессе легкого, остром аппендиците угнетаются метаболические, бактерицидные и рецепторные системы нейтрофилов, что определяет развитие бактериальных ИД;
– рецидивирующие инфекции слизистых оболочек дыхательных путей, кишечника и других органов часто обусловлены недостаточностью sIgA;
– преимущественная активация Тх2 при бактериальных внутриклеточных инфекциях может быть одной из причин возникающей вторичной иммунодефицитной болезни (ВИБ), так как антитела неэффективны;
– гнойные инфекции барьерных тканей – кожи и слизистых оболочек обычно возникают при дефектах местного иммунитета;
– некоторые формы гнойной инфекции развиваются на фоне гиперреактивности – аллергии к бактериальным и другим антигенам: острый аппендицит, острые панкреатит, холецистит и др;
– недостаточность гуморальных и клеточных факторов естественного врожденного иммунитета, служащих первым барьером на пути бактерий, является одной из основных причин развития гнойной инфекции. Дефициты лизоцима, СРБ, МСБ, опсонинов, факторов комплемента, гистатинов и других бактерицидных веществ могут быть основой возникновения инфекции.
Диагностика иммунодефицитных болезней
Широко распространены бактериологическая, иммунологическая (антитела, антигены) и генная диагностика инфекций. Однако состояние СИ при этом не тестируется. Для выявления ИД используются методы оценки иммунного статуса [14, 20]:
I этап. Клинико-лабораторное обследование. Предварительный диагноз иммунопатологии.
II этап. Оценка иммунодефицитного статуса – 1-й уровень:
– определение процента и абсолютного количества Т-лимфоцитов методами с мАТ к CD3, CD4, CD8, CD25
– определение В-лимфоцитов (CD19, CD22, CD72 или Ig+B);
– определение Ig G, М, А, Е в крови и sIgA в слюне;
– фагоцитоз, НСТ-тест нейтрофилов крови;
– определение циркулирующих иммунных комплексов (ЦИК);
– антитела против распространенных бактерий и вирусов;
– определение гемолитической активности комплемента (С50) и/или его компонентов;
– внутрикожные пробы с распространенными антигенами бактерий и грибов (туберкулин, стрептокиназа и др.).
III этап (по показаниям):
– определение ферментов, отсутствующих при первичных ИД (аденозиндезаминазы, пуриннуклеозидфосфорилазы, альфафетопротеин при атаксии; гранул лейкоцитов при гранулематозной болезни);
– оценка интерферонового статуса: концентрация интерферонов в крови; уровень интерферона-альфа и гамма в культуре лимфоцитов крови после стимуляции;
– HLA-типирование;
– выявление цитокинов, в крови методом ИФА и в клетках СИ – методами проточной цитометрии;
– определение общей гамма-цепи рецепторов цитокинов при тяжелом комбинированном иммунодефиците (ТКИД) методом проточной цитометрии.
Принципы лечения иммунодефицитных болезней
Лечение первичных тяжелых ИД и синдромов после уточнения диагноза должно проводиться в специализированных центрах. В России предложены стандарты их лечения с учетом механизмов развития [4].
Необходимо соблюдать общие принципы лечения ИДБ и обосновывать адекватную терапию [4, 22, 23].
Терапия больных с иммунодефицитными болезнями включает [25, 26]:
1) устранение симптомов клинических синдромов, в том числе инфекционных;
2) коррекцию самого иммунодефицита;
3) профилактику рецидивов и осложнений иммунодефицита.
Каждое из этих направлений требует своих методов и подходов. Поэтому схемы лечения ИДБ – это комплекс медикаментозных и немедикаментозных мероприятий.
Терапия инфекционных осложнений. Так как ИДБ проявляются инфекционными осложнениями, противомикробная терапия занимает ключевое место в их лечении. Выбор препаратов зависит от вида микрофлоры и особенностей ИД. Часто бывает необходима комплексная терапия из-за наличия ассоциаций микроорганизмов.
Антибактериальная терапия по существу является иммуностимулирующей. Бактерии, которые разрушаются антибиотиками, выделяют большое количество липополисахаридов (ЛПС) клеточной стенки, которые являются мощными стимуляторами СИ, активируя в первую очередь макрофаги, выделяющие цитокины (ИЛ-1, ФНОальфа и др.), что при нормальном ответе сопровождается лихорадкой. Так как антибактериальная терапия в большинстве случаев является эмпирической, то часто разрушаются аутологичные бактерии, «невиновные» в патологическом процессе, в первую очередь – кишечная палочка. Однако, если был относительный иммунодефицит, то нормально реагирующая СИ активируется ЛПС и больной быстро выздоравливает. При наличии абсолютного ИД этого не поисходит, несмотря на интенсивную антибактериальную терапию наблюдаются обострения, затяжные и хронические процессы. Необходима иная иммунокоррекция.
Следовательно, антимикробные средства не только уменьшают дозу инфектов, но и, разрушая их, создают «аутовакцины», стимулирующие СИ. Особенно эффективны препараты, которые не только не угнетают, но и параллельно стимулируют развитие иммунитета, хотя большинство антибиотиков угнетают те или иные звенья иммунитета [13].
Противовирусные препараты, препятствующие репликации вирусов, освобождают их нуклеиновые кислоты для индукции интерферонов, а капсидные белки – для активации антителогенеза. При наличии вирусной инфекции рекомендуются антивирусные препараты в комбинации с интерферонами [1] или интерфероногенами, а также Т-миметики. Это не исключает применения стимуляторов синтеза антител, особенно при чувствительных к ним инфекциях.
Реконструктивная иммунотерапия. Для восстановления СИ у больных с генетическими дефектами необходимы трансплантация жизнеспособных стволовых клеток СИ донора или генная терапия [23]. Материалом для трансплантации могут служить полипотентные гемопоэтические стволовые клетки крови, костного мозга или эмбриональной печени, фетальный тимус или культивируемый тимический эпителий.
Генная терапия осуществляется путем переноса нормального гена с помощью вектора в клетки больного [26, 27].
Применение иммуномодуляторов при первичных иммунодефицитах.При большинстве среднетяжелых и тяжелых первичных ИД иммуномодуляторы не эффективны и необходима пересадка костного мозга или заместительная терапия иммуноглобулинами. Однако в некоторых случаях они могут быть полезны как средства, усиливающие компенсаторные возможности СИ [15, 16].
При первичной общей вариабельной иммунной недостаточности (ОВИН) с преимущественным нарушением гуморального звена иммунитета в комплексе лечения был испытан полиоксидоний [16]. На этом фоне удалось уменьшить антибактериальную терапию, получить более длительную ремиссию. Отмечено увеличение количества лейкоцитов, лимфоцитов, фагоцитоза.
Особенности лечения вторичных иммунодефицитных болезней (ВИБ).Лечение ИДБ зависит от клинических и патогенетических особенностей и включает: 1) устранение причин, их вызвавших; 2) антибактериальную терапию (по показаниям); 3) иммунокорригирующую терапию; 4) традиционные методы терапии клинических синдромов.
Ориентирами лечения может служить следующий протокол [13, 15].
I. Этап иммунокорригирующей терапии (острый период):
1. Вирусиндуцированные Т-клеточные ИД:
- Противовирусные препараты (ацикловир);
- Интерфероны (альфа, гамма, лейкинферон);
- ?Т-миметики (тактивин, тималин и др.);
- ?Т-цитокины (ИЛ-2-ронколейкин и др.).
1. В-клеточные, ассоциированные с бактериальными инфекциями ИД:
- ?Антибактериальные (противогрибковые) препараты;
- ?Иммуноглобулины (антитела) при тяжелом течении внутривенно;
- ?В-миметики (миелопид и др.);
- ?Иммунокорректоры широкого спектра, комплекс цитокинов.
2. Фагоцитарные:
- ?Антибактериальные (противогрибковые препараты);
- ?Иммуностимуляторы широкого спектра, цитокины;
- ?Интерфероны;
- ?Витамины (С и др.), микроэлементы.
II. Этап противорецидивной иммунореабилитации (при ремиссии):
1. Адаптогены (женьшень, элеутерококк и др.).
2. Иммуностимуляторы растительного происхождения (иммунофан и др.).
3. Санаторно-курортное лечение.
4. Физиотерапия (КВЧ, ультразвук и др.).
5. Иммуностимулирующие вакцины широкого спектра (ликопид, рибомунил, стафилококковый анатоксин и др.).
Вид иммунокоррекции (общая и местная) и ее конкретный метод (физический, химический, биологический) определяются природой дефицита и его принадлежностью к тому или другому варианту нарушения ИС, а в целом – диагнозом ВИБ (рис. 3).
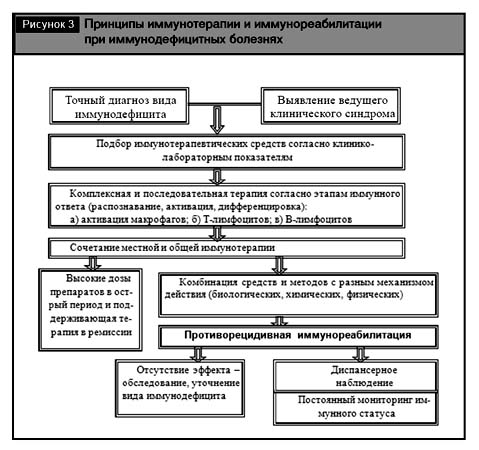
Наиболее эффективно лечение начальных форм иммунодефицитов, для чего необходима ранняя диагностика нарушений в СИ.
Антибактериальная терапиянеобходима при наличии явных очагов инфекции. Причем в ряде случаев предпочтительно местное лечение (тонзиллогенной и других инфекций). Средства пассивной или заместительной терапии – иммуноглобулины используют по показаниям. При затихании острых явлений и в период ремиссии при отсутствии гнойных очагов применяют неспецифическую активную и пассивную иммунотерапию. Среди средств иммуномодулирующей терапии показаны препараты из органов иммунитета (тактивин, тималин, миелопид и др.). Широко применяются иммуномодуляторы, в том числе физические факторы. Последние полезны при затяжных и хронических процессах. Они стимулируют СИ, в том числе факторы местного иммунитета и предпочтительны при наличии лекарственной аллергии.
Для активной неспецифической и полуспецифической терапии используют условно-патогенные микроорганизмы в виде гетеровакцин, состоящих из микробов, колонизирующих дыхательные пути (препараты типа рибомунила), или назначают иммуностимуляторы (ликопид, полиоксидоний). Выбор средств определяется вариантом иммунодефицита, нарушением его определенных звеньев [2, 13].
Сочетание местной и общей иммунокорригирующей терапии позволяет достичь наибольшего клинического эффекта. Комбинированная иммунокоррекция может включать совокупность 3–4 средств и способов различного воздействия, преимущественно влияющих на разные звенья иммунитета [2, 15].
Важным этапом в лечении больных является противорецидивная иммуно-профилактика, проводимая в период ремиссии. Она включает весь арсенал иммунотерапевтических средств и, по существу, представляет собой иммунореабилитацию.
Применение «мягких» иммуностимуляторов в случаях достаточно сохраненной реактивности СИ предупреждает рецидивы заболевания, т.е. обеспечивает иммунореабилитацию. С этой целью в период ремиссии назначают перорально адаптогены, иммуностимуляторы растительного происхождения (эхинацея, женьшень и др.), а также витамины и микроэлементы. Используют курсы физиоиммунотерапии (КВЧ, магнитотерапию и др.) [2, 15].
Главной стратегией борьбы с инфекциями как следствием иммунодефицитов в 21-м веке должно быть иммунопрофилактическое повышение популяционной и индивидуальной неспецифической и специфической резистентности – иммунитета у людей.
Л и т е р а т у р а
1. Ершов Ф.И. Система интерферона в норме и патологии. – М.: Медицина, 1996. – 310 с.
2. Земсков А.М., Караулов А.В., Земсков В.М. Комбинированная иммунокоррекция. – М.: Медицина, 1994. – 250 с.
3. Иммунодефицитные состояния / под ред. В.С. Смирнова, И.С. Фрейдлин. – СПб., 2000. – 557 с.
4. Иммунопатология и аллергология. Стандарты диагностики и лечения / под ред. Р.М.Хаитова. – М., 2001. – 105 с.
5. Инфекционные болезни /под ред. В.И. Покровского. – 1996. – 527 с.
6. Клиническая иммунология и аллергология: учеб. пособие / под ред. Караулова А.В. – М.: Мед. информ. агентство, 2002. – 651 с.
7. Лебедев К.А., Понякина Н.Д. Иммунная недостаточность. – М., 2003. – 440 с.
8. Новиков Д.К. Клиническая аллергология. – Мн., 1991. – 511 с.
9. Новиков Д.К. Медицинская иммунология. – Мн., 2005. – 234 с.
10. Новиков Д.К. Патология системы иммунитета. – М., 2003. – 366 с.
11. Новиков Д.К. // Иммунопатол., аллергол., инфектол. – 2002. – № 2. – С. 7–12.
12. Новиков Д.К. //Иммунопатол., аллергол., инфектол. – 2002. – № 1. – С. 5–15.
13. Новиков Д.К., Новиков П.Д. Клиническая иммунопатология. – М.: Мед. лит., 2009. – 448 с.
14. Новиков Д.К., Новикова В.И. Оценка иммунного статуса. – М., 1996. – 244 с.
15. Новиков Д.К., Новикова В.И., Сергеев Ю.В. // Иммунопатол., аллергол., инфектол. – 2002. – № 3. – С. 7–18.
16. Робсон А., Ройт А., Делвз П. Основы медицинской иммунологии.– М.: Мир, 2006. – 319 с.
17. Семенов Б.Ф., Зверев В.В. //Сб. тр. Соврем. пробл. аллергологии, иммунологии и иммунофармакол. – 2002. – Т. 1. – С. 113–126.
18. Хаитов Р.М. Иммунология. – М.: ГЭОТАР-медиа, 2009. – 311 с.
19. Хаитов Р.М., Пинегин Б.В. // Иммунология. – 1999. – № 1. – С. 14–17.
20. Хаитов Р.М., Пинегин Б.В., Ярилин А.А. Руководство по клинической иммунологии. Диагностика заболеваний иммунной системы. – М.: ГЭОТАР-медиа, 2008. – 352 с.
21. Ярилин А.А. Основы иммунологии. – М.: Медицина, 1999. – 606 с.
22. Clinical immunology / ed. J. Bradley, J. McCluskey. – Oxford University Press, 1997.
23. Conley M.E. (ed.) Section on immunodeficiency // Cur. Opinion in Immunology. – 2003. – N15. – P. 567–598.
24. DeFranco A., Locksley R., Robertson M. Immunity. – New Science Press Ltd., 2007. – 387 р.
25. Ficher A. // Clin. Exp. Immunol. – 2000. – N 2. – P. 143–149.
26. Primary Immunodeficiency Disiases. Report of a WHO Scientific Group //Clin. Exper. Immunol. – 1997. – N 109 (Suppl.). – P. 1–28.
27. Rosen F.C., Seligmn M. Immunodeficiencies. – Harvard Acad. Publ. Chur., 1993.
Медицинские новости. – 2011. – №5. – С. 6-13.
Внимание! Статья адресована врачам-специалистам. Перепечатка данной статьи или её фрагментов в Интернете без гиперссылки на первоисточник рассматривается как нарушение авторских прав.








